分组:每一次实验分为不染组、单染AnnexinV组、单染PI组以及PI和AnnexinV双染组,处理组按从低到高进行双染;
染色:用PBS把4×bindingbuffer稀释到1×缓冲液,吸净离心管残余的PBS后,每管加入100μL的1×的bindingbuffer,用移液枪吹打细胞使细胞充分重悬,避光条件下加入染料。不染组不加,正宗流式测细胞因子, 流式检测设备报价相关,单染组加AnnexinV或PI5μL,查流式测细胞因子,电火花检测仪相关,AnnexinV和PI双染组加入AnnexinV和PI各5μL,并用移液枪轻轻混匀;
上机检测:室温避光孵育15分钟后,加入1×的bindingbuffer300μL并混匀后避光下将细胞悬液转移到5mL的流式管中,1h内在流式细胞仪上机检测。
三、数据分析
AnnexinV-FITC/PI凋亡检测试剂盒是用FITC标记的AnnexinV作为探针,FITC最大激发波长为488nm,最大发射波长525nm,FITC的绿色荧光在FL1通道检测;PI-DNA复合物的最大激发波长为535nm,最大发射波长为615nm,PI的红色荧光在FL2或FL3通道检测。
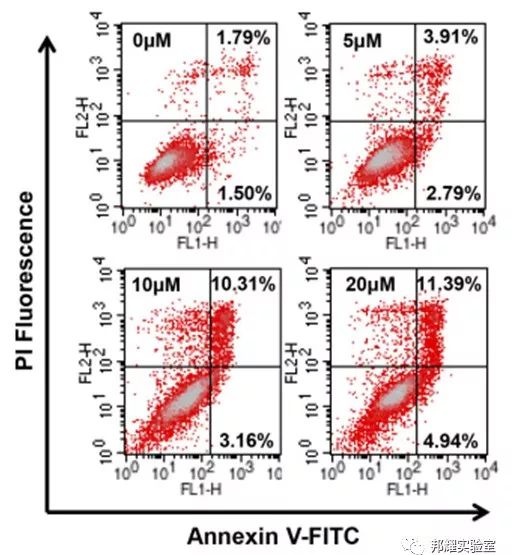
举例:如常用于研究药物或者基因等对细胞凋亡的影响。通过比较Control组和药物组,发现化合物可以诱导前列腺癌细胞系PC-3M的细胞凋亡,处理组(20μM)的晚期凋亡细胞比例与Control组(0μM)相比,从1.79%上升到11.39%。进而还可根据每个象限的数据计算出活细胞、凋亡细胞和坏死细胞百分率。
四、常见问题解答
1.如何避免出现假阳性结果?
细胞接种不易过密:接种对数生长期的细胞时密度不要>1*106,以免细胞培养过程中自身引起凋亡,而非外界处理因素;
避免消化过度:因消化过度可能会造成PS外翻,得到假阳性的结果。因此消化时最好用低浓度胰酶消化,轻柔吹打贴壁细胞2-3次,尽量把胰酶造成损伤可以控制在5%以内,加上对照组的情况下对实验结果不会造成明显影响;
首先,明确一下细胞凋亡和坏死的区别
细胞凋亡(apoptosis)是一件主动性细胞死亡事件,它涉及一系列基因的激活、表达以及调控,是细胞为更好地适应环境而主动争取的一种死亡过程。具体表现为:出芽形成凋亡小体、核小体间DNA的切割,凋亡小体被吞噬和消化等几个连续过程等
细胞坏死(necrosis)则是一件被动的过程,是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程,即病理条件下,长沙科文生物科技有限公司,科文生物科技,自体损伤的一种现象。具体表现为:细胞胀大,胞膜破裂,细胞内容物外溢,核变化较慢,DNA降解不充分,查流式测细胞因子, 流式检测设备价格相关,会引起局部严重的炎症反应
一、流式检测细胞凋亡的原理
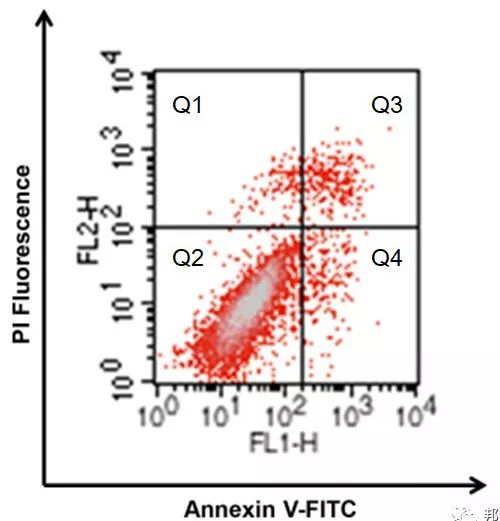
AnnexinV和PI双染法是流式检测细胞凋亡的经典方法,它是基于凋亡的早期细胞膜上的磷脂酰丝氨酸(phosphotidylserine,PS)从细胞膜的内侧翻转到细胞膜的表面这一原理来实现的
该方法简便、快速、准确区分活细胞、凋亡细胞和坏死细胞,具体原理如下:
AnnexinⅤ(膜联蛋白V)是一种分子量为35-36kDa的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,将AnnexinV进行荧光素FITC标记,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶(Propidium,PI)是一种可与DNA结合的染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。
因此,将AnnexinV与PI联合使用时,便可用来鉴别活细胞,凋亡细胞及死亡细胞。
二、实验操作步骤
收集细胞:取适量的对数生长期细胞接种于6孔板中,在相应的条件下(如药物)处理相应时间后,收集细胞,注意要合并上清和消化下来的细胞(注:悬浮细胞直接离心即可);
清洗细胞:用预冷的PBS洗2遍细胞;
操作尽量轻柔:收集细胞时力度过大很可能造成细胞膜损伤,导致细胞膜的磷脂层暴露,从而结合AnnexinV,导致假阳性,因此处理贴壁细胞时要小心操作,尽量避免人为的损伤。
2.为什么必须收集细胞上清?
因为凋亡的细胞可能会脱壁,悬浮于培养基,所以必须收集上清再离心取沉淀,合并胰酶消化下来的细胞,不然检测出来的凋亡比例可能会减少。
3.为什么在染色后1h内就要上机检测?
由于细胞凋亡是一个快速的过程,建议样品在染色后1小时之内进行分析;PI受时间的影响很大,因标记了PI后会加大细胞毒性,特别是检测早期凋亡时,如果时间延长除了会导致在流式细胞仪上的细胞分群差距加大外,误差会明显加大,所以建议在一个小时内检测。
4.其他注意事项
消化是关键步骤,注意消化时间和操作力度,过短的话细胞需要用力吹打才能脱落,容易造成膜损伤,过长又易造成假阳性;
AnnexinV-FITC和PI是光敏物质,在操作时请注意避光;
避免洗涤时细胞损失过多,可考虑在吸液时用大的Tip头套上小的Tip头吸液;
上机检测时,必须重悬成细胞悬液后再检测,否则容易堵仪器管道;如果细胞过多或聚团严重,可先用300目(孔径40~50微米)尼龙网过滤,然后再上机检测;
注意:FITC为绿色荧光,此检测方法不适用于已带绿色荧光标签的细胞;
如果样品来源于血液,请务必除去血液中的血小板。因为血小板含有PS,能与AnnexinV结合,从而干扰实验结果。
